La Commissione europea ha concesso l’autorizzazione all’immissione in commercio per filgotinib (200 mg e 100 mg compresse), di Gilead e Galapagos.
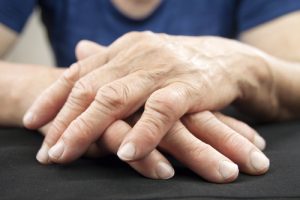
Il farmaco viene somministrato per via orale una volta al giorno e agisce inibendo selettivamente la Janus chinasi di tipo 1 (JAK1) in pazienti affetti da artrite reumatoide da moderata a severa, che hanno avuto una risposta inadeguata o che sono intolleranti a uno o più farmaci antireumatici modificanti la malattia (DMARDs, disease-modyfing-antirheumatic-drugs). Filgotinib può essere utilizzato in monoterapia o in combinazione con metotrexato.
La decisione della Commissione Europea si basa sui dati relativi a oltre 3.500 pazienti trattati con filgotinib nel corso dei programmi di fase 3 FINCH e di fase 2 DARWIN. Negli studi FINCH, filgotinib ha costantemente soddisfatto i criteri ACR20/50/70, con miglioramenti in tutti i singoli componenti ACR rispetto al placebo o a metotrexato.
Una percentuale significativamente più alta di pazienti trattati con filgotinib 200 mg più metotrexato o altri farmaci antireumatici convenzionali sintetici modificanti la malattia ha ottenuto una bassa attività di malattia e/o una remissione clinica (DAS28-CRP≤3,2 e DAS28-CRP <2,6) alle settimane 12 e 24 rispetto al placebo o a metotrexato.
Nei pazienti che hanno avuto una risposta inadeguata a metotrexato, il trattamento con filgotinib più metotrexato ha prodotto un’inibizione statisticamente significativa della progressione del danno articolare strutturale rispetto al placebo più metotrexato, come valutato utilizzando il punteggio totale Sharp modificato (mTSS, modified Total Sharp Score) alla settimana 24.
Nello studio di estensione a lungo termine di fase 2 DARWIN 3, condotto in aperto, i pazienti che hanno ricevuto filgotinib 200 mg in monoterapia o con metotrexato hanno mantenuto risposte ACR20/50/70 durevoli fino a tre anni.
Negli studi FINCH e DARWIN le reazioni avverse più comuni sono state nausea, infezioni del tratto respiratorio superiore, infezioni del tratto urinario e capogiri. I tassi di herpes zoster e polmonite sono stati non comuni. La frequenza di infezioni gravi nel braccio filgotinib 200 mg è stata dell’1,0%, rispetto allo 0,6% nel braccio placebo.
In un’analisi di sicurezza integrata effettuata in sette studi clinici, i tassi di eventi avversi cardiaci maggiori (MACE, major adverse cardiac events) e di tromboembolia venosa (TEV) con filgotinib sono stati paragonabili al placebo. I tassi di infezioni gravi sono rimasti stabili con l’esposizione a lungo termine.
“Filgotinib, il primo farmaco di Galapagos approvato da parte dell’autorità regolatoria, è il risultato del forte impegno profuso verso bisogni medici insoddisfatti”, dice Daniel O’Day, Presidente e Amministratore delegato di Gilead Sciences. “Siamo impazienti di continuare la nostra collaborazione con Galapagos per contribuire ad offrire numerose e nuove soluzioni ai pazienti in futuro.”
“L’annuncio di oggi rappresenta un motivo d’orgoglio per tutti noi di Galapagos, poiché rappresenta un riconoscimento per gli anni di ricerca e di impegno, allo scopo di portare un cambiamento significativo nella vita dei pazienti che devono affrontare i sintomi dell’artrite reumatoide”, ribadisce Onno van de Stolpe, Amministratore delegato di Galapagos. “Questa notizia conferma ulteriormente l’efficacia e il profilo di sicurezza di filgotinib; siamo impazienti di poter rendere disponibile questo importante trattamento ai medici e ai pazienti di tutta Europa il più rapidamente possibile”.
Secondo l’accordo di collaborazione, Galapagos riceverà un pagamento di 75 milioni di dollari per il riconoscimento del traguardo raggiunto con l’approvazione di filgotinib da parte della Commissione Europea.